In questa relazione di laboratorio vedremo come si esegue la standardizzazione dell' acido cloridrico e dell' acido acetico con pH-metro.
1. Scopo della determinazione
Lo scopo dell’esperienza è quello di determinare il titolo in Normalità di una soluzione di HCl circa 0,1 N ed una soluzione di CH3COOH circa 0,1 N. Trattandosi di soluzioni ottenute da composti che non sono standard primari, la titolazione è essenziale per l'utilizzo di queste come titolanti nell'analisi volumetrica in chimica analitica.
2. Principio del metodo
Le soluzioni di Acido Cloridrico ed Acido Acetico vengono fatte reagire con quantità note di un opportuno standard secondario (NaOH titolato) per titolazione diretta. Dal volume di titolante utilizzato al punto di equivalenza, ottenuto dalla curva di titolazione, si risale al titolo in Normalità.
La curva di titolazione è ottenuta sperimentalmente misurando il pH (con un pH-metro) dopo ogni aggiunta di titolante, i dati ottenuti vengono inseriti in un sistema di assi cartesiani (in ascissa si riporta il volume di titolante aggiunto mentre in ordinata il valore di una variabile critica). Per le titolazioni acido-base la variabile critica è il pH poiché in corrispondenza del p.e. subisce una variazione brusca e repentina.
Per registrare una curva di titolazione ottimale, in prossimità del p.e. i volumi di titolante aggiunti dovrebbero essere i più piccoli possibili; raccogliere più dati in questa zona ci permetterà di avere una maggiore precisione sul calcolo del volume di equivalenza.
La curva di titolazione si presenta di forma sigmoidale, e tale forma dipende dagli equilibri e dalle concentrazioni delle specie in soluzione.
Per calcolare il volume di titolante al punto di equivalenza si può operare in diversi modi:
- Interpolazione lineare. Dopo aver disegnato la curva su carta millimetrata, si traccia una linea retta in corrispondenza del pH al p.e., dunque si legge il volume sull’asse delle ascisse tracciando una seconda linea verticale.
- Derivata della funzione. Si calcola la derivata prima o la derivata seconda della funzione –log[H+]. Nel punto di flesso della curva di titolazione (che corrisponde al nostro p.e.) il grafico della derivata prima presenterà il suo valore massimo, mentre il grafico della derivata seconda cambierà di segno. Si legge dunque il Volume di titolante in corrispondenza di questi punti.
Siccome col pH misuriamo la concentrazione molare degli ioni H3O+ in soluzione, e le concentrazioni sono dipendenti dalla diluzione, sarebbe opportuno evitare di diluire la soluzione durante la titolazione per registrare una curva che indichi correttamente il valore di pH. Questo non è possibile in quanto addizioniamo un progressivo volume di titolante. Per correggere questo errore sarebbe potremmo ricalcolare i valori di pH considerando la diluizione. Per semplicità si può minimizzare l’errore aumentando il volume della soluzione da titolare all’inizio (es. a 25 mL di HCl si addiziono ~ 100 mL di acqua) cosi che il volume di titolante aggiunto durante la titolazione ha effetti modesti sul volume totale. E’ però necessario non diluire ulteriormente durante la titolazione.
3. Materiale e strumentazione
- Buretta graduata da 50 mL
- Becker da 100 mL e da 400 mL
- bacchettina di vetro
- Agitatore magnetico e magnete
- pH-metro
4. Reattivi
- Soluzione di HCl circa 0,1 N
- Soluzione di CH3COOH circa 0,1 N
- Soluzione di NaOH titolato (0,1010 N)
- Buffer di calibrazione a pH 4, 7 e 10
- Acqua deionizzata
5. Procedimento
La procedura di titolazione è la medesima per entrambi gli acidi presi in considerazione.
Dopo aver calibrato il pH-metro utilizzando le opportune soluzioni di calibrazione scelte il funzione del range di pH nel quale vogliamo maggiore precisione, si può procedere alla titolazione.
Dunque si prelevano 25 mL di acido, si addizionano 100 mL di acqua deionizzata e si misura il pH sotto costante agitazione registrandone il valore.
Si addizionano successivi piccoli volumi di titolante (1 mL per volta), registrando per ogni aggiunta il relativo valore di pH.
In prossimità del p.e. si procede addizionando goccia a goccia il titolante (variazione di + 0,05 mL o ± 0,1 mL) per ottenere una curva di titolazione ottimale.
Proseguire fino a pH di circa 12 unità (volume titolante 40 mL).
6. Calcolo del risultato
Il titolo della soluzione è espresso in Normalità (eq/L). La formula da applicare per il calcolo è la seguente:
N (eq/L) = Vt * Nt / Vp
Dove:
Vt = Volume di titolante al p.e. calcolato come sopra descritto (in L)
Nt = Normalità del titolante (in eq/L)
Vp = Volume di acido prelevato (in L)
7. Presentazione dei risultati ( HCl )
7.1 Dati Sperimentali
Nella seguente tabella vengono riportati i dati ottenuti in laboratorio ed il corrispondente grafico ottenuto col software Microsoft Excel.
|
mL |
pH |
|
mL |
pH |
|
mL |
pH |
|
mL |
pH |
|
mL |
pH |
|
0,00 |
2,02 |
|
21,00 |
2,50 |
|
24,40 |
3,01 |
|
25,45 |
3,67 |
|
26,20 |
10,37 |
|
5,00 |
2,02 |
|
21,50 |
2,55 |
|
24,50 |
3,04 |
|
25,50 |
3,79 |
|
26,30 |
10,50 |
|
10,00 |
2,07 |
|
22,00 |
2,59 |
|
24,60 |
3,09 |
|
25,55 |
3,93 |
|
26,40 |
10,61 |
|
15,00 |
2,20 |
|
22,50 |
2,65 |
|
24,70 |
3,12 |
|
25,60 |
4,17 |
|
26,50 |
10,70 |
|
16,00 |
2,26 |
|
23,00 |
2,71 |
|
24,80 |
3,17 |
|
25,70 |
4,58 |
|
27,00 |
10,96 |
|
17,00 |
2,30 |
|
23,50 |
2,80 |
|
24,90 |
3,20 |
|
25,75 |
5,60 |
|
27,50 |
11,12 |
|
18,00 |
2,33 |
|
23,70 |
2,85 |
|
25,00 |
3,24 |
|
25,80 |
6,60 |
|
28,00 |
11,24 |
|
18,50 |
2,35 |
|
23,90 |
2,87 |
|
25,10 |
3,31 |
|
25,85 |
8,54 |
|
29,00 |
11,40 |
|
19,00 |
2,38 |
|
24,00 |
2,90 |
|
25,15 |
3,36 |
|
25,90 |
9,26 |
|
30,00 |
11,50 |
|
19,50 |
2,41 |
|
24,10 |
2,93 |
|
25,20 |
3,41 |
|
25,95 |
9,68 |
|
35,00 |
11,75 |
|
20,00 |
2,44 |
|
24,20 |
2,95 |
|
25,30 |
3,48 |
|
26,00 |
9,95 |
|
40,00 |
11,88 |
|
20,50 |
2,47 |
|
24,30 |
2,99 |
|
25,40 |
3,56 |
|
26,10 |
10,18 |
|
|
|

7.2 Descrizione della curva ottenuta
La reazione acido-base avvenuta durante la titolazione è la seguente:
HCl + NaOH <-> Cl- + Na+ + H2O pHeq = 7,00 (a 25 °C)
1) Il pH iniziale è dato dal solo acido forte in soluzione, considerando di aver preso 25 mL di HCl 0,1 N ed aver aggiunto 100 mL di acqua, ci aspettiamo un pH di:
[H+] = 0,025 mL* 0,1 eq/L / 0,125 mL = 0,02 eq/L pH = 1,70
Il pH-metro ha letto pH=2 probabilmente perché avrò diluito inavvertitamente oltre 125 mL oppure non risulta tarato bene a questi valori di pH.
2) Al p.e. il pH è lo stesso di quello di una soluzione di NaCl, dunque sarà dato dalla Kw dell’acqua alla temperatura della soluzione (24 °C come indicato sul pH-metro) cioè ~ 7 unità pH.
3) Dopo il p.e. il pH è dato dall’eccesso di NaOH addizionato, e ad esempio dopo aver aggiunto 40 mL di titolante ci aspettiamo:
[OH-] = (nNaOH – nHCl) / Vol. soluzione = (0,040 * 0,10 - 0,025 * 0,1 ) / 0,165 mL = 9,09 x 10-3 mol/L
[H+] = Kw / [OH-] = 1,1 x 10-12 pH = 11,95
Il nostro valore di pH letto era di 11,88 e questo conferma la supposizione di prima di aver diluito eccessivamente all’inizio della titolazione.
7.3 Elaborazione dei dati
Di seguito vengono riportati i dati ottenuti dall’elaborazione dei dati sperimentali con l’uso del software OriginLab Pro.
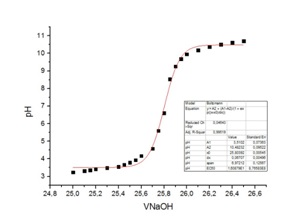
- Punti selezionati per il Fit sigmoidale: 22 punti (da 25 a 26,5 mL)
- Volume di NaOH dalla derivata seconda: 25,8036 mL
- Titolo dell’HCl 0,1042 eq/L
- pH al punto di equivalenza 6,9894 unità pH

8. Presentazione dei risultati (CH3COOH)
8.1 Dati Sperimentali
Nella seguente tabella vengono riportati i dati ottenuti in laboratorio ed il corrispondente grafico ottenuto col software Microsoft Excel.
|
mL |
pH |
|
mL |
pH |
|
mL |
pH |
|
mL |
pH |
|
mL |
pH |
|
0,00 |
3,22 |
|
8,50 |
4,43 |
|
17,00 |
5,10 |
|
23,40 |
8,75 |
|
25,50 |
11,19 |
|
0,50 |
3,41 |
|
9,00 |
4,47 |
|
17,50 |
5,14 |
|
23,45 |
9,11 |
|
26,00 |
11,30 |
|
1,00 |
3,57 |
|
9,50 |
4,50 |
|
18,00 |
5,20 |
|
23,50 |
9,39 |
|
26,50 |
11,36 |
|
1,50 |
3,70 |
|
10,00 |
4,55 |
|
18,50 |
5,25 |
|
23,55 |
9,62 |
|
27,00 |
11,42 |
|
2,00 |
3,75 |
|
10,50 |
4,58 |
|
19,00 |
5,32 |
|
23,60 |
9,80 |
|
27,50 |
11,47 |
|
2,50 |
3,81 |
|
11,00 |
4,62 |
|
19,50 |
5,38 |
|
23,65 |
9,92 |
|
28,00 |
11,52 |
|
3,00 |
3,87 |
|
11,50 |
4,66 |
|
20,00 |
5,46 |
|
23,70 |
10,04 |
|
29,00 |
11,59 |
|
3,50 |
3,95 |
|
12,00 |
4,69 |
|
20,50 |
5,54 |
|
23,75 |
10,21 |
|
30,00 |
11,64 |
|
4,00 |
4,01 |
|
12,50 |
4,73 |
|
21,00 |
5,64 |
|
23,80 |
10,31 |
|
31,00 |
11,70 |
|
4,50 |
4,06 |
|
13,00 |
4,77 |
|
21,50 |
5,76 |
|
23,90 |
10,41 |
|
32,00 |
11,74 |
|
5,00 |
4,12 |
|
13,50 |
4,81 |
|
22,00 |
5,90 |
|
24,00 |
10,54 |
|
33,00 |
11,79 |
|
5,50 |
4,18 |
|
14,00 |
4,84 |
|
22,50 |
6,14 |
|
24,10 |
10,64 |
|
34,00 |
11,81 |
|
6,00 |
4,22 |
|
14,50 |
4,88 |
|
22,70 |
6,29 |
|
24,20 |
10,71 |
|
35,00 |
11,84 |
|
6,50 |
4,26 |
|
15,00 |
4,92 |
|
23,00 |
6,56 |
|
24,30 |
10,78 |
|
40,00 |
11,93 |
|
7,00 |
4,31 |
|
15,50 |
4,96 |
|
23,20 |
6,96 |
|
24,40 |
10,84 |
|
|
|
|
7,50 |
4,35 |
|
16,00 |
5,01 |
|
23,30 |
7,17 |
|
24,50 |
10,90 |
|
|
|
|
8,00 |
4,39 |
|
16,50 |
5,05 |
|
23,35 |
7,73 |
|
25,00 |
11,07 |
|
|
|

8.2 Descrizione della curva ottenuta
La reazione acido-base avvenuta durante la titolazione è la seguente:
CH3COOH + NaOH <-> CH3COO- + Na+ + H2O pHeq = (a 25 °C)
1) Il pH iniziale è dato dal solo acido debole in soluzione, considerando di aver preso 25 mL di CH3COOH 0,1 N (Ka = 1,8 * 10-5) ed aver aggiunto 100 mL di acqua, ci aspettiamo un pH di:
[H+] = radq (Ka * Ca) = radq (1,8 x 10-5 * 0,025 mL* 0,1 eq/L / 0,125 mL) = 6 * 10-4 eq/L pH = 3,2
Ed approssimativamente il nostro pH iniziale è stato questo.
2) Alle prime aggiunte di NaOH il pH sale rapidamente perché l’acido debole ha basso potere tampone. Successivamente invece si vede che il pH varia di meno in seguito alle aggiunte di base per via della formazione del tampone CH3COOH / CH3COO- .
3) Al punto di equivalenza abbiamo una soluzione acquosa di acetato di sodio. Gli anioni provenienti da acidi deboli reagiscono con l’acqua per formare l’acido debole e da cui derivano.
L’anione acetato dà quindi il suo acido coniugato secondo la reazione:
CH3COO- + H2O <-> CH3COOH + OH-
Il pH di questa reazione è dato da:
[OH-] = radq (Kb * Cb) = radq (5,56 x 10-10 * 0,025 mL* 0,1 eq/L / 0,150 mL ) = 3,04 x 10-6
[H+] = Kw / [OH-] = 3,29 x 10-9 pH = 8,48
Ed infatti dal grafico si vede che il punto centrale del tratto verticale della curva è proprio intorno a 8,4.
4) Dopo il p.e., anche qui come per l’HCl, il pH è dato dall’eccesso di NaOH e per lo stesso calcolo di prima ci aspettiamo un pH = 11,95 dopo l'aggiunta di 40 mL di titolante. Effettivamente abbiamo letto 11,93.
8.3 Elaborazione dei Dati
Di seguito vengono riportati i dati ottenuti dall’elaborazione dei dati sperimentali con l’uso del software OriginLab Pro.

- Punti selezionati per il Fit sigmoidale: 24 punti (da 21,5 a 24,5 mL)
- Volume di NaOH dalla derivata seconda: 23,3919 mL
- Titolo dell’CH3COOH 0,0945 eq/L
- pH al punto di equivalenza 8,3505 unità pH

9. Conclusioni
Per l'Acido cloridrico abbiamo ottenuto una curva descritta molto bene nel tratto in corrispondenza del p.e. raccogliendo molti valori. Per l'acido acetico invece avremmo dovuto prendere più dati nel tratto che precede il p.e. (da 22 a 23,2 mL), nonostante questo la curva dei 24 punti selezionati sembra avere un buon andamento.
Il valore di pH calcolato sperimentalmente al p.e. per la titolazione dell’HCl è venuto 6,99, dunque molto prossimo a quello atteso di 7,00. Questa è una conferma di come il pH-metro sia stato calibrato correttamente nel punto che più ci interessa per la nostra esperienza.
Il titolo dell’HCl ottenuto in questa esperienza è di 0,1042 N, mentre nell’esperienza passata (Standardizzazione acido cloridrico 0,1 N ed idrossido di sodio 0,1 N) avevamo ottenuto 0,1058 N. Questa differenza è normale in quanto i due metodo hanno principi differenti e sono affetti da errori diversi.
In linea di principio si dovrebbe preferire il dato ottenuto mediante titolazione con standard primario (0,1058 N) perché affetto da un minor numero di errori. Le incertezze per questo metodo sono quelle dovute a: taratura della bilancia e vetreria, purezza dello standard e uso dell’indicatore. Mentre nella titolazione con pH-metro abbiamo gli errori dovuti a: calibrazione dello strumento, preparazione delle soluzioni di calibrazione, taratura della bilancia e vetreria e uso di uno standard secondario (NaOH).
Uno standard secondario ha un titolo con incertezza maggiore rispetto ad uno standard primario, come descritto nella guida Eurachem Citag CG 4 "Quantificazione dell'incertezza nelle misure analitiche" infatti:
- uno standard primario di Na2CO3 con purezza del 99,95 % (certificata dal produttore) ha un incertezza tipo relativa u(x)/x =0,0003.
- una soluzione 0,1 N di NaOH titolata con ftalato acido di potassio ha un incertezza tipo relativa u(x)/x = 0.0010. (N.B. è considerata una ripetibilità dell'operatore su 10 prove CV% = 0,05).
Per l’acido acetico non abbiamo altri valori di Normalità da confrontare.




